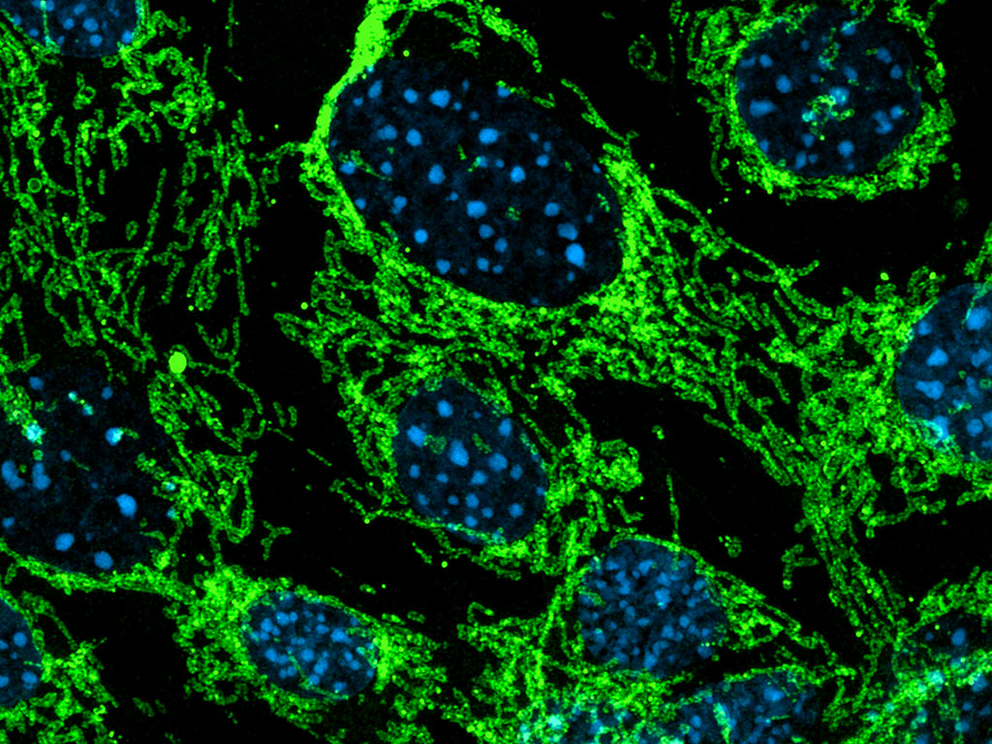
Die Steuerung des Zellstoffwechsels beruht auf einem koordinierten und möglichst harmonischen Zusammenspiel von Zellkern und Mitochondrien. Einerseits bilden die Mitochondrien die Drehscheibe für die Produktion wichtiger Stoffwechselprodukte, die nicht nur zur Deckung des Energiebedarfs der Zelle benötigt werden, sondern auch als Bausteine genetische und epigenetische Funktionen im Zellkern dienen. Auf der anderen Seite wird, auch wenn Mitochondrien eigene DNA vorhalten, der größte Teil der mitochondrialen Stoffwechselenzyme durch das Genom des Zellkerns kodiert. Das bedeutet, dass die Funktion dieser beiden Organellen in hohem Maße voneinander abhängig ist. Die Kommunikation zwischen den Organellen wird durch Moleküle unterstützt, die zwischen den beiden Kompartimenten hin und her wandern. Die Histonacetyltransferase MOF, ein Enzym und klassischer epigenetischer Regulator, ist ein solcher Wanderer zwischen diesen beiden Welten.
Ein Team von Forschenden des Max-Planck-Instituts für Immunbiologie und Epigenetik hat nun in Zusammenarbeit mit Wissenschaftler*innen der Universitäten Freiburg und Bonn den entscheidenden Einfluss von MOF auf die Zellphysiologie und -funktion in Bereichen außerhalb des Zellkerns aufzeigen können. Die Studie, die in der Fachzeitschrift Nature Metabolism veröffentlicht wurde, belegt die zentrale Rolle von MOF bei der Aufrechterhaltung der mitochondrialen Integrität durch einen Prozess, der als Proteinacetylierung bezeichnet wird. Die Ergebnisse werfen ein Licht auf die spezifische Maschinerie, die für die Regulierung der Acetylierung von Proteinen im Mitochondrium verantwortlich ist, und vertiefen das Verständnis, wie Zellen ihre Stoffwechselproduktion fein abstimmen.
MOF als eine molekularer Brückenbauer zwischen Epigenetik und Stoffwechsel
„MOF ist ein hoch konserviertes Protein. Das heißt, wir finden es in der Fruchtfliege Drosophila, in der Maus und im Menschen. Zusammen mit anderen Molekülen bildet es einen Komplex, der Histonproteine acetyliert und so die Transkription aktiviert. Im Zellkern ist unsere DNA um diese Histone gewickelt und bildet Chromatin. Durch die Aktivität von MOF werden Acetylgruppen an die Histone angehängt, wodurch sich die Verpackungsdichte des Chromatins lockert, die DNA zugänglicher wird und die Gene abgelesen werden können,“ erklärt Prof. Dr. Asifa Akhtar. Akhtar ist Direktorin am Max-Planck-Institut für Immunbiologie und Epigenetik in Freiburg und Mitglied des Exzellenzclusters CIBSS - Centre for Integrative Biological Signalling Studies an der Universität Freiburg.
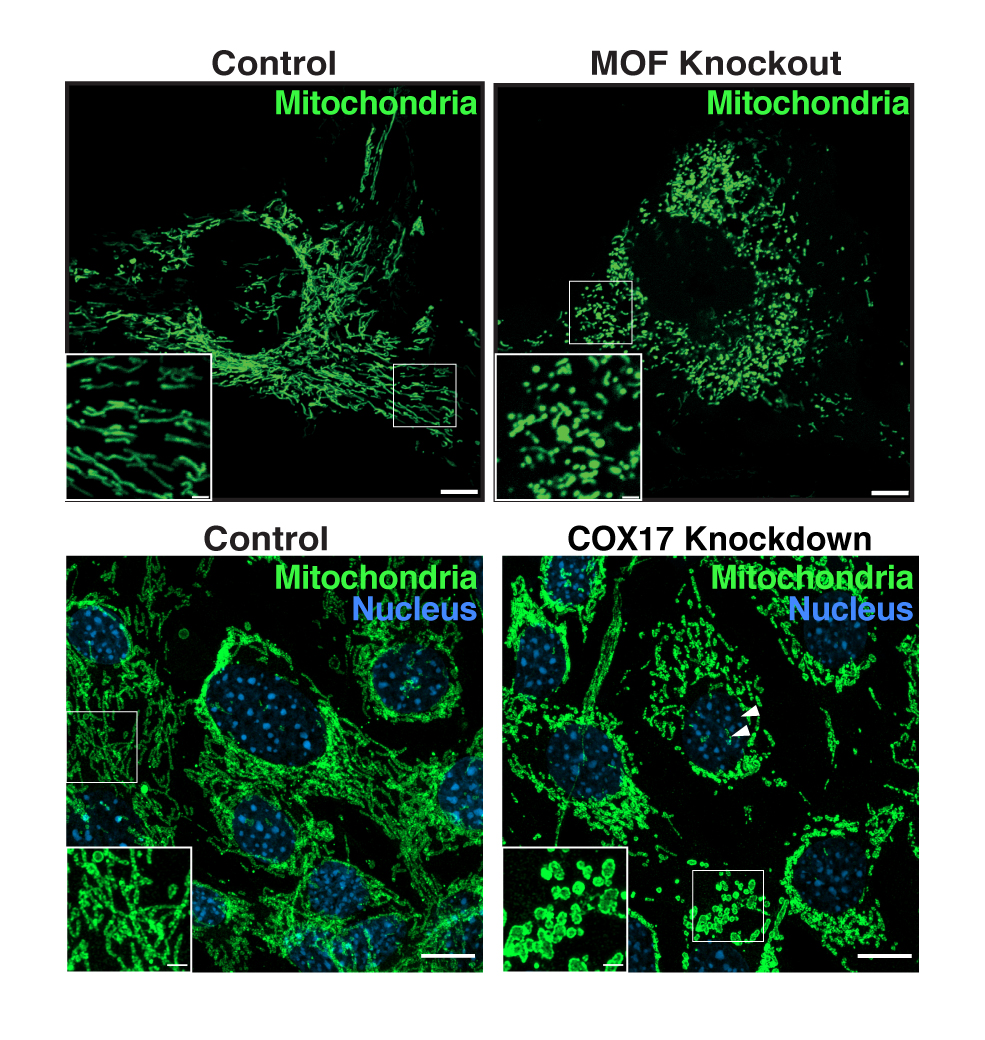
In früheren Studien konnte das Labor von Akhtar MOF und mehrere Partnerproteine in Mitochondrien nachweisen. Die genauen Auswirkungen der enzymatischen Aktivität von MOF auf das Mitochondrium und den Stoffwechsel blieben jedoch unbekannt. „Die Beobachtung, dass MOF außerhalb des Zellkerns vorkommt, hat unser Interesse geweckt. Wir wollten herauszufinden, was diese Acetyltransferase mit den Proteinen der Mitochondrien und damit auch die Proteinacetylierung als generelles Phänomen in Mitochondrien zu untersuchen“, sagt Sukanya Guhathakurta, Erstautorin der Studie.
Protein-Acetylierung jenseits der Histon-Proteine
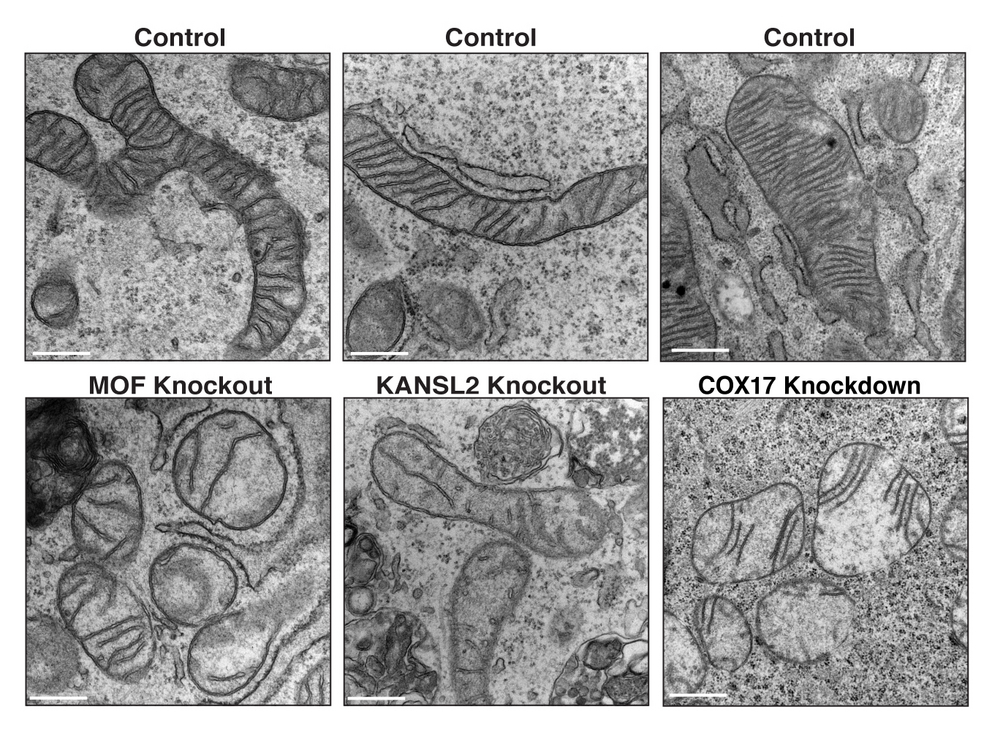
Nun hat die Zusammenarbeit zwischen dem Team von Asifa Akhtar und den Gruppen von Prof. Dr. Thomas Becker (Universität Bonn), Prof. Dr. Nikolaus Pfanner (CIBSS, Universität Freiburg) und Prof. Dr. Bettina Warscheid (CIBSS, jetzt Universität Würzburg) eine zentrale Rolle für MOF bei der Regulierung der mitochondrialen Physiologie und Funktion zeigen können. „In unseren Studien an Mäusen haben wir eine spezielle Gruppe von mitochondrialen Proteinen identifiziert, deren Acetylierungsstatus sich beim Verlust von MOF ändert, was zu einer Kaskade von mitochondrialen Defekten führt – einschließlich Fragmentierung, weniger Einstülpungen der inneren Membran (sog. Cristae) und beeinträchtigter oxidativer Phosphorylierung“, sagt Guhathakurta. Mitochondrien sind die »Kraftwerke der Zelle«. Ihre Funktion ist entscheidend für die zelluläre Energieproduktion und für viele physiologische Prozesse. Eine Störung ihrer Physiologie und Funktion wurde bei verschiedenen Krankheiten wie Krebs, Herzversagen und neurodegenerativen Erkrankungen nachgewiesen.