Transportmechanismus als wichtiger Baustein
„Unsere Experimente entschlüsseln 40 Jahre nach der Entdeckung der mitochondrialen Signalsequenzen jetzt den genauen Mechanismus, wie die Proteine transportiert und die Kraftwerke unserer Zellen Schritt für Schritt aufgebaut werden“, sagt Wiedemann. „Die Aufklärung des Transportmechanismus für mitochondriale Proteine ist ein wichtiger Baustein für die zelluläre Grundlagenforschung.“ Fehlfunktionen von über 500 der mitochondrialen Proteine sind Ursache unterschiedlicher Krankheiten. Daher hat die Erforschung der Mitochondrien eine große Bedeutung für die Medizin.
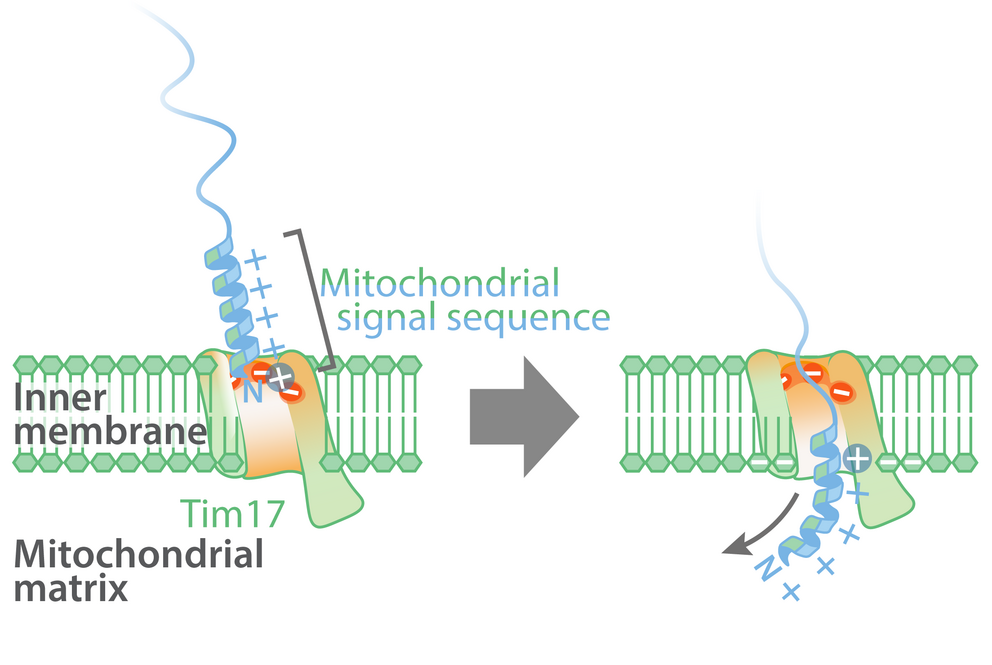
Bereits bekannt war, dass die mitochondrialen Proteine über die Signalsequenz-Translokase der mitochondrialen Innenmembran (TIM) in die mitochondriale Matrix importiert werden. Diese wird unter anderem aus den zwei lebensnotwendigen Hauptuntereinheiten Tim23 und Tim17 gebildet. Bisher ging man davon aus, dass die mitochondrialen Proteine mit Signalsequenz durch einen wassergefüllten Tim23-Kanal über die innere Mitochondrienmembran transportiert werden. Neueste, auf künstlicher Intelligenz basierende Strukturvorhersagen zeigen aber, dass Tim23 gar keinen Kanal in der Membran bildet. Das Forschungsteam konnte nun nachweisen, dass die mitochondrialen Proteine mit Signalsequenzen tatsächlich über eine Furche des Tim17-Proteins in die Mitochondrien importiert werden.
Negativ geladene Furche des Tim17-Proteins
Die meisten Proteine, die in die Mitochondrien transportiert werden, enthalten eine komplexe molekulare Signalsequenz, welche auf einer Seite positiv geladen und wasserlöslich ist und auf der gegenüberliegenden Seite fettlösliche Molekülreste besitzt. Im Gegensatz zur positiv geladenen Seite des Transportsignals besitzt die Furche von Tim17 einen stark negativ geladenen Bereich, welcher in allen Tim17-Proteinen von Hefen bis zum Menschen vorhanden ist.
Die Erstautor*innen der Studie Dr. Laura Fielden und Dr. Jakob Busch vom Institut für Biochemie und Molekularbiologie der Universität Freiburg konnten mit funktionellen in-vitro-Transportexperimenten anhand von chemisch markierten Proteinen mit isolierten Mitochondrien zeigen, dass die negativen Ladungen in der Furche von Tim17 mit den positiv geladenen Signalsequenzen wechselwirken und damit essentiell für den Transport von mitochondrialen Proteinen sind: Die fettlösliche Seite der mitochondrialen Signalsequenzen wird dadurch zur Lipidmembran ausgerichtet und ermöglicht den Transport der Signalsequenzen an der Grenzfläche zwischen Tim17 und der mitochondrialen Innenmembran.
Grundlage für weitere Forschungen
„Erst mit der Aufklärung dieses grundlegenden Mechanismus von mitochondrialen Proteinen mit einer Signalsequenz an der Grenzfläche zur Biomembran können wir nun verstehen, warum mitochondriale Signalsequenzen eine positiv geladene und eine fettlösliche Seite besitzen und für ihren Transport benötigen“, erklärt Fielden die Bedeutung der Ergebnisse. Diese können nun als Grundlage für weitere Forschung zu Mitochondrien dienen.
Originalpublikation:
Fielden, L.F., Busch, J.D., Merkt, S.G., Ganesan, I., Steiert, C., Hasselblatt, H.B., Busto, J.V., Wirth, C., Zufall, N., Jungbuth, S., Noll, K., Dung, J.M., Butenko, L., von der Malsburg, K., Koch, H.-G., Hunte, C., van der Laan, M., Wiedemann, N.: Central role of Tim17 in mitochondrial presequence protein translocation. In: Nature (2023). https://doi.org/10.1038/s41586-023-06477-8