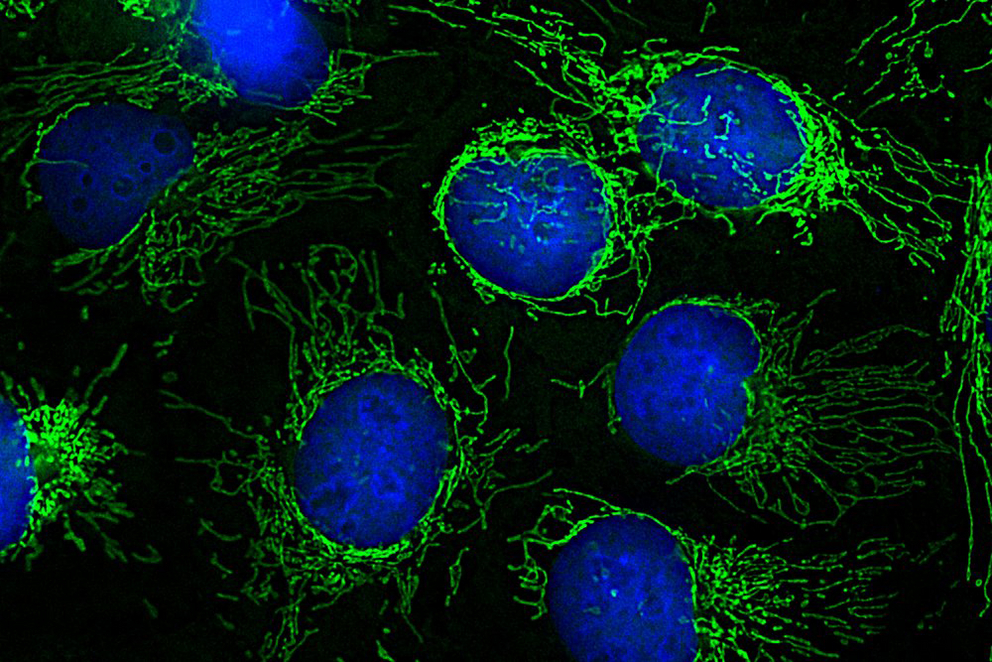
Kombination mehrerer experimenteller Ansätze
Früher wurden Eiweiße als mitochondrial bezeichnet, wenn sie mit biochemischen Analysetechniken in gereinigten Mitochondrien nachweisbar waren. Heute wissen Forschende, dass diese Methode ungenau ist: „Die Nachweissysteme sind mittlerweile so empfindlich geworden, dass die meisten Eiweiße – unabhängig von ihrem Ursprung in der Zelle – in gereinigten Mitochondrien auftauchen,“ erklärt Wiedemann. Um dieses Problem zu überwinden, haben die Forschenden mehrere experimentelle Ansätze miteinander kombiniert: Sie haben die Eiweiß-Zusammensetzung von stärker und weniger stark gereinigten Mitochondrien miteinander und mit den Daten von anderen Zellbestandteilen verglichen. In weiteren Experimenten haben sie den Transport von Eiweißen aus dem Zellinneren in Mitochondrien blockiert. So konnten sie sehen, welche Eiweiße normalerweise auf diesem Weg in die Mitochondrien gelangen. „Wir konnten mit diesen verschiedenen Ansätzen 1134 Eiweiße identifizieren, die in Mitochondrien vorliegen – und zwar in mehreren unabhängigen Experimenten und in unterschiedlichen menschlichen Zelltypen, was die Ergebnisse sehr zuverlässig macht“, erklärt Warscheid, deren Team bisher unbekannte Bestandteile von Mitochondrien identifizierte.
Zusammenhänge von Erkrankungen des Herz-Kreislaufs- und Nervensystems erforschen
Um auf die Funktionen der bisher unbekannten Eiweiße zu schließen, untersuchten die Forschenden deren Interaktionen mit anderen Eiweißen innerhalb der Mitochondrien. So konnten sie zum Beispiel ein Eiweiß beschreiben, das für den Zusammenbau einer molekularen Maschinerie für die Zellatmung benötigt wird. „Unsere Analyse solcher Eigenschaften im Zusammenhang mit Krankheitssymptomen zeigt zum Beispiel auch, dass Defekte von Eiweißen, die für die Bildung des Energieträgers ATP wichtig sind, besonders häufig das Herz-Kreislauf-System betreffen“, erläutert Wiedemann. Insgesamt führen Defekte von mitochondrialen Eiweißen besonders häufig zu Erkrankungen des Herz-Kreislaufs- und Nervensystems. Die neuen Erkenntnisse des Forschungsteams erlauben es, diese Zusammenhänge im Detail zu erforschen.
Zu den Autor*innen:
Bettina Warscheid ist Arbeitsgruppenleiterin am Institut für Biologie II. Nils Wiedemann, Nikolaus Pfanner und Claudine Kraft leiten Arbeitsgruppen am Institut für Biochemie und Molekularbiologie. Sie alle sind Mitglieder des Exzellenzclusters CIBSS Centre for Integrative Biological Signalling Studies und der Spemann Graduiertenschule für Biologie und Medizin an der Albert-Ludwigs-Universität. Warscheid, Wiedemann und Pfanner leiten außerdem Projekte im Zentrum für biologische Signalstudien BIOSS.
Originalpublikation:
Morgenstern, M., Peikert, C.D., Lübbert, P., Suppanz, I., Klemm, C., Alka, O., Steiert, C., Naumenko, N., Schendzielorz, A., Melchionda, L., Mühlhäuser, W.W.D., Knapp, B., Busch, J.D., Stiller. S.B., Dannenmaier, S., Lindau, C., Licheva, M., Eickhorst, C., Galbusera, R., Zerbes, R.M., Ryan, M.T., Kraft, C., Kozjak-Pavlovic, V., Drepper, F., Dennerlein, S., Oeljeklaus, S., Pfanner, N., Wiedemann, N., Warscheid, B. (2021): Quantitative high-confidence human mitochondrial proteome and its dynamics in cellular context. In: Cell Metabolism. DOI: 10.1016/j.cmet.2021.11.001